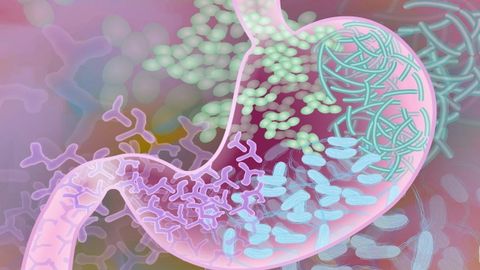
Un estudio pionero revela que los genes tienen «vida social» y que el ADN de nuestros compañeros de piso influyen en el microbioma intestinal
18 dic 2025 . Actualizado a las 14:07 h.Los genes de nuestros compañeros de piso podrían estar influyendo en las bacterias que habitan nuestro intestino. Así lo demuestra un estudio liderado por el Centro de Regulación Genómica (CRG) realizado en más de 4.000 ratas y publicado en Nature Communications, que revela que la composición del microbioma intestinal no depende únicamente de la genética individual, sino también de la de aquellos con quienes se comparte el entorno.
El hallazgo describe una nueva forma de «herencia social» a través del intercambio de bacterias, virus y hongos, los microorganismos que conviven en nuestro organismo y que conforman el microbioma. Investigadores del CRG y la Universidad de California en San Diego han descubierto que los genes poseen una «vida social» que trasciende al individuo, permitiendo que el ADN de un compañero moldee la composición de las bacterias intestinales de los demás miembros del grupo.
Aunque el ADN no salta de una persona a otra, los microbios sí lo hacen, y la investigación confirma que ciertos genes favorecen la proliferación de bacterias específicas que se propagan mediante el contacto estrecho, alterando la biología de los compañeros sin modificar su código genético.
«No es magia, sino el resultado de influencias genéticas que se extienden a otros a través del contacto social. Los genes modelan el microbioma intestinal y hemos comprobado que no solo importan nuestros propios genes», explica la doctora Amelie Baud, investigadora del Centro de Regulación Genómica (CRG) de Barcelona y autora principal del estudio.
Al utilizar ratas bajo dietas controladas, el equipo identificó tres regiones genéticas clave: el gen St6galnac1, que añade azúcares a la mucosidad para alimentar a la bacteria Paraprevotella; los genes de mucina, que forman la capa protectora intestinal y afectan a las Firmicutes; y el gen Pip, que codifica una molécula antibacteriana vinculada a la familia Muribaculaceae.

El estudio es pionero al cuantificar que, al incluir estos efectos sociales en los modelos estadísticos, la influencia genética total sobre las bacterias se multiplica entre cuatro y ocho veces, lo que sugiere que solo se ha descubierto la «punta del iceberg» de cómo los genes modelan el riesgo de enfermedad de todo un entorno social.
Estos mecanismos biológicos podrían ser compartidos por los humanos, donde el gen equivalente ST6GAL1 se ha relacionado con casos de Covid-19 en vacunados, posiblemente porque la bacteria Paraprevotella degrada enzimas que el virus usa para infectar células.
Los investigadores también plantean una hipótesis sobre por qué algunas personas desarrollan la nefropatía por IgA, una enfermedad renal. Paraprevotella podría alterar la IgA, un anticuerpo que protege el intestino pero que, cuando se altera, puede filtrarse al torrente sanguíneo y formar agregados que dañan los riñones, el rasgo característico de la nefropatía por IgA.
El equipo de la doctora Baud estudiará ahora en detalle cómo St6galnac1 influye en Paraprevotella en ratas y qué reacciones biológicas en cadena desencadena en el intestino y en todo el organismo.
«Estoy obsesionada con esta bacteria. Nuestros resultados están respaldados por datos de cuatro instalaciones independientes, lo que significa que podemos realizar estudios de seguimiento en cualquier nuevo entorno. Además, son extraordinariamente sólidos en comparación con la mayoría de las relaciones huésped-microbioma. Es una oportunidad única», concluye la doctora Baud.
En humanos, solo dos genes se han vinculado hasta ahora de forma fiable con las bacterias intestinales: el gen de la lactasa, que influye en los microbios que digieren la leche y determina si los adultos pueden digerirla, y el gen del grupo sanguíneo ABO, que afecta a los microbios mediante mecanismos desconocidos. Es probable que existan más asociaciones entre genes y microbios, pero ha sido difícil determinarla, por lo que el estudio realizado ahora con ratas, que comparten muchs características de la biología de los mamíferos, abre nuevas expectativas para adentrarse en un universo desconocido.
«Aunque los detalles serán diferentes en los humanos de lo que encontramos en las ratas, el estudio señala el camino hacia la comprensión de los mecanismos de cómo los genes del huésped y microbianos trabajan juntos para producir enfermedades complejas en las que está involucrado el microbioma, que van desde enfermedades cardiovasculares hasta obesidad y alzhéimer», apunta el coautor del trabajo, Rob Knight, profesor de Ciencias de la Computación e Ingeniería en Universidad de California San Diego y director del Centro de Innovación en Microbiomas.
